近日,中国科学院合肥物质科学研究院强磁场中心王俊峰研究员课题组,依托稳态强磁场实验装置(SHMFF),在蛋白仿生矿化与金属有机框架(MOFs)结合的研究中取得重要进展,成功构建了一种由蛋白笼包裹的生物型纳米金属有机框架材料,大幅提升了其结构稳定性、亲水性、生物相容性和药物负载能力。相关研究成果发表在国际权威期刊Nano Letters上。
金属有机框架(MOFs)因其高孔隙率、可调节的结构和优异的药物负载能力,近年来备受关注。然而,MOFs在生物应用中存在稳定性、亲水性和生物利用度较低及药物泄漏等问题,限制了其在生物医学领域的广泛应用。在肿瘤药物靶向递送中,亟需开发更稳定、高效的纳米载体,以提高药物递送效率并降低毒性。
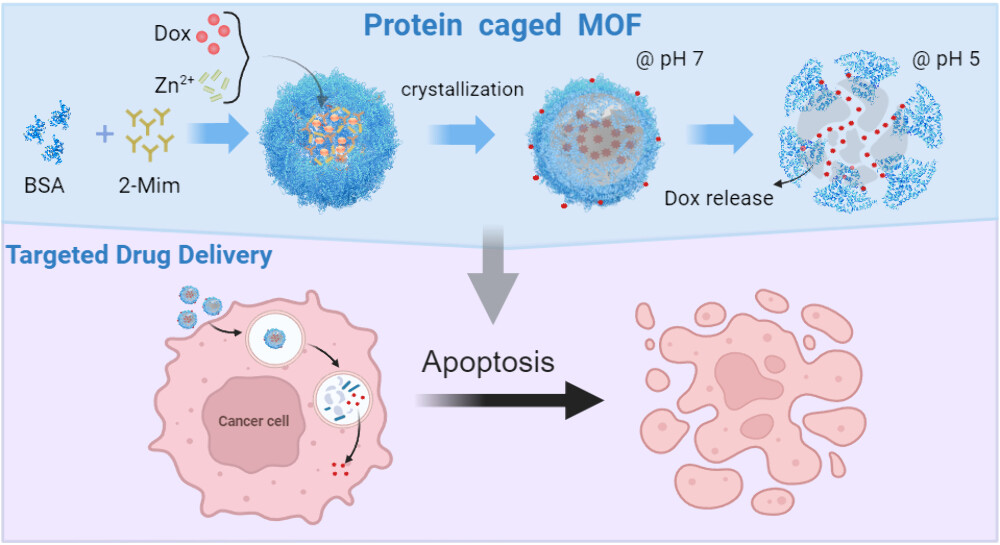
在本研究中,团队基于此前的仿生矿化技术研究(Journal of Materials Chemistry B, 2017;ACS Applied Materials & Interfaces, 2020;PNAS, 2022, Chemical Engineering Journal, 2023, Small 2024),利用生物矿化的BSA(牛血清白蛋白)作为模板,成功调控了锌基MOF(ZIF-8)的晶体结构,合成了具有高稳定性和尺寸均一性的生物型MOF材料(BSA@ZIF-8)。这种由矿化蛋白BSA调控金属节点的纳米结构将MOFs的尺寸从150 nm显著降低至65 nm,并提升了其在复杂生物环境中的稳定性和生物相容性。实验结果表明,与传统的ZIF-8相比,BSA@ZIF-8在体外和体内均表现出显著的抗肿瘤药物递送效果。特别是在负载抗癌药物多柔比星(Doxorubicin, DOX)后,BSA@ZIF-8能够在肿瘤微环境的酸性条件下(pH 5.0)实现精准释放,同时在中性条件下(pH 7.4)保持稳定,显著减少了药物的非特异性泄漏。研究显示,BSA@ZIF-8的最大药物载量达到了16μg/mg,并能高效富集进入肿瘤细胞内部。此外,通过SHMFF核磁共振(NMR)、二维及三维细胞荧光实验等多种技术手段,研究进一步揭示了BSA@ZIF-8与肿瘤细胞的相互作用机制及药物释放机制。结果表明,BSA蛋白的外壳结构不仅显著提高了MOFs的生物稳定性,还增强了肿瘤细胞的靶向性和药物递送效率。
该研究的实验结果在体内小鼠模型中得到进一步验证。与传统载药MOFs相比,BSA@ZIF-8在抑制肿瘤生长方面展现了优越的效果,治疗组小鼠的肿瘤体积显著缩小,并显示出更长的生存时间。此外,该材料的血液学和组织学分析也显示出良好的生物相容性,未引起明显的毒性反应。本研究不仅展示了BSA@ZIF-8在肿瘤治疗中的应用潜力,还为未来蛋白-金属有机框架的设计和功能化提供了新的思路,进一步推动了纳米医学和肿瘤治疗领域的发展。
强磁场中心博士后Sajid ur Rehman、健康所博士后孔帅、强磁场中心博士研究生张静为共同第一作者,强磁场中心王俊峰研究员、马坤副研究员及健康所蒋远副研究员为共同通讯作者。该研究工作得到了科技部外国青年专家计划、国家自然科学基金、科技部重大专项、中国科学院合肥物质院院长基金等的支持。
论文链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.4c04147?ref=pdf
图1:生物型MOF BSA@ZIF-8结构状态的透射电镜图
图2:展示了用于靶向药物输送的 BSA 笼状 MOF 的创建过程。封装的化疗药物DOX在酸性微环境中被策略性地释放,从而诱导恶性细胞凋亡。

© 1996 - 强磁场科学中心 版权所有 皖ICP备05001008号-11
地址:安徽省合肥市蜀山湖路350号 邮编:230031 电话:0551-65591149 传真:0551-65591149 邮箱:chmfl@hmfl.ac.cn